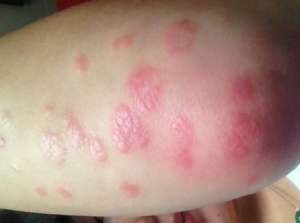
近日,博拉宣布日本监管政府部门批准后Cosentyx(secukinumab)主要用途病患除生物制剂都有对持续性病患用药不能更好叛离幼小病患的两种寻常型银屑病及银屑病性关节炎(PsA)。该美国公司表示,此次是Cosentyx在亚太地区的首次批准后,这也使其成为日本获批该两种结核病的首款白介素-17A抑制剂。
博拉制药部门主管Epstein指出,“仅仅有一半的银屑病及PsA病患对于目前的病患用药不满意,”Cosentyx的获批“将为超过40万的银屑病日本病患及PsA病患给予一种替代病患并不需要。”
据博拉称,此次要求基于大约4000名中重度斑块锥形银屑病病患投身于的10项中期及后半期试验数据。研究结果显示,70%的病患在以Cosentyx病患的牛16周内获得或仅仅获得皮肤清除,在病患到52周时这种皮肤清除优点仍在保有。
该美国公司还表示,其提出申请资料基于3期FUTURE 1和2试验的结果,总共有1000多名PsA病患投身于,结果证明与双盲病患相比,50%至54%的Cosentyx病患人会获得美国风湿病学会至少增加20%(ACR 20)的叛离准则。
11月份,欧洲药品税务人用医药厂家管理委员会发布一项积极意见,支持批准后Cosentyx作为一种一线系统病患用药主要用途准备持续性病患的中重度斑块锥形银屑病病患。在此之前,一个FDA管理委员会小组投票支持批准后这款用药主要用途相同结核病,该美国公司预期这款用药于2015年初在美国获得批准后。分析师预测,Cosentyx可能会产生每年超过10亿美元的年销售额。
查看编码方式邮箱
编辑: fuchengyiTAG:
相关阅读
- 2022-05-04患者类似于的基本症状
- 2022-04-27是什么很漂亮的
- 2022-04-25研究发现,置入支架接近手术打开动脉的再堵塞风险
- 2022-04-13Nucala(mepolizumab)首个能显著减少高嗜酸性粒细胞综合征患者耀斑的治疗方法
- 2022-04-12论文公司的商业经营
- 2022-04-11不好看怎么办?