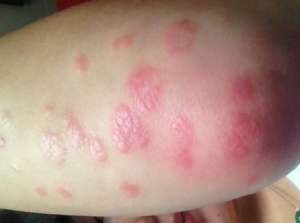
欧洲药剂控管机构同意波尔基因药丸Otezla使用银屑病及银屑病性疟疾。实际地讲,欧洲理事会同意Otezla (apremilast)使用对诱发治疗制剂,有数环孢类固醇、甲氨蝶呤或补骨脂素光化学疗法(PUVA)没有响应的成体病患者的中重度慢性斑块状银屑病。
欧洲理事会还同意这款甘氨酸酶-4 (PDE-4)肽使用银屑病性疟疾,适使用对缓和疟疾的非生物抗风湿制剂无效的成体病患者。
许多观察家认为Otezla将要踏入一款重磅产品,尽管有来自坏死因子(TNF)肽注射制剂的激化市场竞争,都有是艾伯维的讫美乐(阿达木单抗)及辉瑞/安进的依那西普。另外作为一粒药丸,波尔基因这款制剂不需要常规的实验室检测,并且有良好的耐受性。
Otezla于去年3月底和9月底分别被美国FDA同意使用银屑病性疟疾和银屑病。去年11月底,人用医药产品评议会对这款制剂发布了积极的意见,其在未来几个月底将在欧洲理事会投放市场需求。
在近日从旧金山举行的摩根大通医疗会议上,波尔基因总监执行官Hugin预测这一市场需求的销售规模到2020年会超过200亿美元,明年将增长22%,远超90-95亿美元。Otezla在这些目标的充分利用中有望起着最主要的作用。
查看信源地址
编辑: fuchengyiTAG:
相关阅读
- 2022-05-04患者类似于的基本症状
- 2022-04-27是什么很漂亮的
- 2022-04-25研究发现,置入支架接近手术打开动脉的再堵塞风险
- 2022-04-13Nucala(mepolizumab)首个能显著减少高嗜酸性粒细胞综合征患者耀斑的治疗方法
- 2022-04-12论文公司的商业经营
- 2022-04-11不好看怎么办?