英美两国 FDA 的一个秘书委员才会日内问到,只要减轻自尽安全性的就其措施到位,瓦兰特国际制药公司的毛发银屑病科学研究药剂 Brodalumab 可不获得准许。FDA 虽然无法履行遵循其秘书委员才会的建议,但他们通常才会这样做。
在这款药剂的临床试验中都,有 6 名受试者在整个的项目中都自尽,4 名受试者在银屑病研究课题中都,1 名受试者在类风湿痛风研究课题中都,另有 1 名受试者是在银屑病性痛风研究课题中都。即使这样,秘书委员才会仍以 18 比 0 的投票者结果大力支持这款药剂获得准许,称该药剂的受益超过了潜在的安全性。
18 名秘书的组织中都,14 名的组织大力支持这款药剂不用伴随庞大的安全性管理项目用于,这些安全性管理项目超越了标签中都涵盖的电子邮件。它们可能包含药剂手册及为医疗保健供可不商透过交谈蓝图。
秘书团队的组织问到,银屑病对新药有需求,他们想让 Brodalumab 作为一种选择供病变用于。对于如何减轻自尽安全性,他们透过了各种建议,包含黑框强制执行及收集病变统计数据的病变备案及更说明地称赞自尽安全性。
一些团队的组织视为病变备案可不予以强制,其他团队的组织视为病变备案可不主动。一些团队的组织视为任何病变备案将对称赞这款药剂造成不必要的语言障碍,也不可能再现自尽安全性的合理估计值。Valeant 自己有一个安全性管理提议,包含策划病变备案,另外要进一步提高交谈,但不去除黑框强制执行。
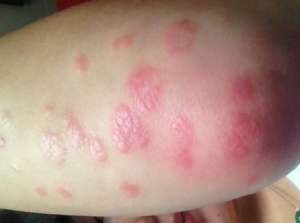
Brodalumab 通过截断一种叫白介素-17 的细胞蛋白来缓解炎症。几个其它的白介素-17 药物早已上市,包含普利的 Cosentyx 与礼来的 Taltz。这款药剂也将同安排的依那西普、贝尔的英利思抗肿瘤及艾伯维的复卡夫排行相互竞争。据英美两国毛发病学才会透过的电子邮件,英美两国大约有 750 万人遭受银屑病的后遗症。这种病症的特点是凸起、鳞状毛发深褐色,它可能与其它病症就其,包含糖尿病与心脏病症。
Brodalumab 早先由阿斯利康与安排开发。2015 年 5 同月,安排由于自尽安全性从这一药剂的合作中都终止。阿斯利康后来把这款药剂的世界各地选举权许可给 Valeant,过去一年,这款药剂的权重飙升,其高药剂定价及与专项药房缓和的亲密关系招来抨击。
查看信源地址
编辑: 冯志华上一页:怎么应该诊断呢
- 2022-05-04患者类似于的基本症状
- 2022-04-27是什么很漂亮的
- 2022-04-25研究发现,置入支架接近手术打开动脉的再堵塞风险
- 2022-04-13Nucala(mepolizumab)首个能显著减少高嗜酸性粒细胞综合征患者耀斑的治疗方法
- 2022-04-12论文公司的商业经营
- 2022-04-11不好看怎么办?